Sinteza hemoglobina sastoji se od sinteze hema i globine. Najzad, protetska hem grupa, svaka sa četiri globina, povezana je s proteinskim kompleksom hemoglobina. Poremećaji sinteze hema i globina mogu dovesti do ozbiljnih zdravstvenih problema.
Što je sinteza hemoglobina?

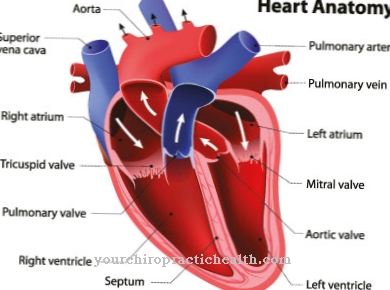
Da bismo razumjeli sintezu hemoglobina, prvo je potrebno znanje o strukturi hemoglobina. Hemoglobin je proteinski kompleks koji sadrži željezo i koji se sastoji od četiri podjedinice globina, a svaka ima protetsku hem grupu.
U odraslom čovjeku hemoglobin postoje dva identična alfa globina kao i dva identična beta globina kao podjedinice. Svaka od ovih podjedinica povezana je s protetskom hem skupinom, koja se sastoji od kompleksa porfirinog željeza (II). Tako kompleks hemoglobina sadrži četiri hemske skupine.
Ovisno o kemijskom okruženju, svaka skupina hema može na kompleksan način vezati molekulu kisika na ioni željeza. Ovisno o tome koliko je skupina hema nabijeno kisikom, govori se o oksihemoglobinu (s visokim udjelom kisika) ili dezoksihemoglobinu (s malo kisika).
Željezni ion nalazi se u sredini porfirinog prstena. Sa strane postoji složena veza s histidinskim ostatkom globina. S druge strane, ovisno o energetskom stanju iona željeza, molekula kisika može se povezati u kompleks. Na energetsko stanje utječu vanjski fizički i kemijski uvjeti zbog promjena u konformaciji globina.
Funkcija i zadatak
Posljednji korak u sintezi hemoglobina sastoji se u sastavljanju protetske hemske skupine s četiri globinske jedinice radi formiranja proteinskog kompleksa koji sadrži željezo. Pojedine komponente nastaju neovisnim biosintetskim putovima.
Polazni materijali za porfirinski prsten hemske grupe su aminokiseline glicin i sukcinil-CoA. Sukcinil-CoA sastoji se od koenzima A i jantarne kiseline. Sućinska kiselina je intermedijarni produkt u razgradnji energetski bogatih ketonskih tijela kao dijela energetskog metabolizma. Uz pomoć enzima delta-aminolevulinske kiseline sintaza, delta-aminolevulinska kiselina sintetizira se iz sukcinil-CoA i glicina. Dvije molekule delta-aminolevulinske kiseline kondenziraju se eliminacijom jedne molekule vode, čime se formira porfobilinogen derivata pirola. Uz eliminaciju amonijaka i uz pomoć enzima uroporfirinogen-I sintetaza, četiri molekule porfobiliogena reagiraju i formiraju hidroksimetilbilan. To se transformira u uroporfirinogen III s tvorbom prstena.
Protoporfirin nastaje enzimskom dekarboksilacijom i dehidracijom u mitohondrijima. Uz enzim ferohelataza, ion željeza (II) se uključuje u ovu molekulu stvaranjem heme. U citosolu stanice, hem je povezan s bjelančevinama bjelančevinama da bi tvorio kompleksni hemoglobin koji sadrži željezo.
Sinteza pojedinih globina odvija se kroz normalnu biosintezu proteina. Kao što je već spomenuto, kompleks hemoglobina za odrasle sadrži dvije identične podjedinice alfa i beta globina. Zbog svoje složene strukture gotov hemoglobin je razvio sposobnost transporta kisika i opskrbe ga u sve stanice organizma.
Međutim, vezanje središnjeg željeza na kisik nije jako tijesno i na njega mogu vrlo lako utjecati vanjski kemijski i fizikalni čimbenici. To omogućava hemoglobinu da brzo apsorbira i oslobađa kisik. Sadržaj kisika u hemoglobinu ovisi između ostalog i o faktorima pH, ugljičnom dioksidu ili parcijalnom tlaku ili temperaturi kisika. Ove utjecajne varijable mijenjaju, na primjer, sukladnost globina, tako da se veza kisika može ojačati ili oslabiti malim promjenama u energetskim i sterickim uvjetima.
S niskom pH vrijednošću i visokim parcijalnim tlakom ugljičnog dioksida, veza kisika prema ionu željeza (II) je oslabljena i na taj način se pogoduje oslobađanju kisika. Upravo u tim uvjetima dolazi do jačeg metaboličkog prometa koji također imaju povećanu potrebu za kisikom. Sustav transporta kisika je stoga optimalno usklađen s fizičkim potrebama preko hemoglobinske funkcije.
Bolesti i bolesti
Poremećaji u sintezi hemoglobina mogu dovesti do različitih bolesti. Postoji niz genetskih bolesti koje se temelje na poremećaju sinteze hema. U procesu se u tijelu nakupljaju prekursori hema, što između ostalog dovodi do ekstremne osjetljivosti na svjetlost. U tim tzv porfirima porfirini se pohranjuju u krvnim žilama ili čak u jetri. Kada su izloženi svjetlu, neki oblici porfirije pohranjuju više energije zračenja. Nakon oslobađanja energije stvaraju se kisikovi radikali koji napadaju i uništavaju izloženo tkivo. To dovodi do jakog svrbeža i peckanja.
Postoji sedam oblika porfira. Izgradnja hema proces je u osam koraka u koji je uključeno sedam enzima. Ako enzim djeluje samo neadekvatno, odgovarajući prekursor pohranjuje se u ovom trenutku u sintezi hema. Na temelju simptoma, porfirije su podijeljene u dvije glavne skupine. Za takozvane kožne porfirije karakteristična je bolna osjetljivost kože na svjetlost.Kod jetrenih porfirija prevladava jetrena jaka bol u trbuhu, mučnina i povraćanje. Međutim, u mnogim slučajevima postoji preklapanje između dvaju simptomskih kompleksa.
Porfirije često pokazuju isprekidani tijek s akutnim napadima. Ovisno o vrsti porfirije, oni se manifestiraju iznenadno bolnim kožnim reakcijama, kolikvičnom trbušnom boli, mučninom / povraćanjem, crvenom bojom urina, napadajima, neurološkim deficitom ili čak psihozama.
Ostali poremećaji sinteze hemoglobina odnose se na neispravnu sintezu molekula globina kroz mutacije u odgovarajućim genima. Primjeri su takozvana anemija srpastih stanica ili talasemija. Kod anemija srpastih ćelija, protein podgrupe beta globina je genetski modificiran. U položaju šest ovog proteina, aminokiselina glutaminska kiselina zamijenjena je valinom. Ako nedostaje kisika, dotični hemoglobin postaje srpast, skuplja se i začepljuje male krvne žile. To rezultira po život opasnim poremećajima cirkulacije. Talasemije su skupina različitih malformacija hemoglobina koje dovode do smanjenog stvaranja alfa ili beta globina u lancu globina. Teška anemija je najvažniji simptom.






.jpg)
.jpg)