Aldehid oksidaza je enzim koji razgrađuje aldehide u kralježnjaka. Može se naći u različitim tkivima sisavaca i ljudi. Točna funkcija aldehidne oksidaze još nije poznata.
Što je aldehidna oksidaza?
Aldehid oksidaza (AOX1) pomaže u enzimskom razgradnji aldehida u tijelu. Međutim, ustanovljeno je da i on razgrađuje nikotin u kotinin. Atom kisika ugrađen je u nikotin bez kisika da tvori aldehidnu strukturu.
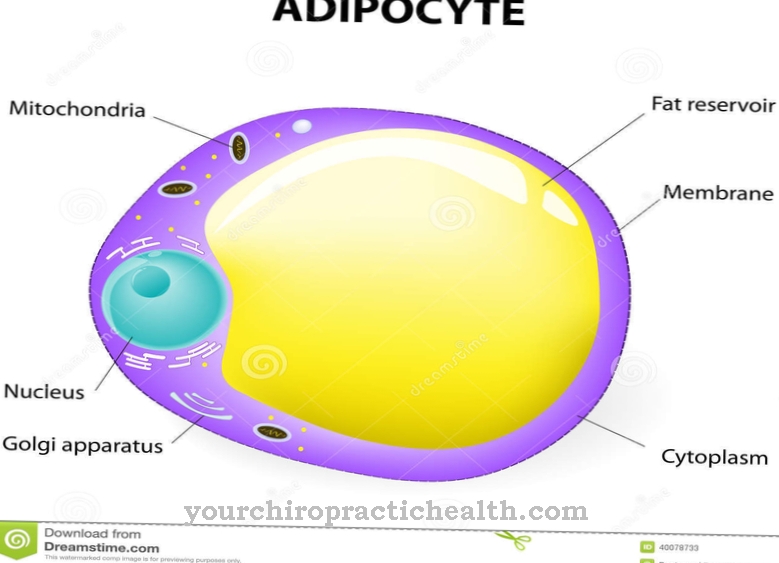
Zbog ove činjenice, aldehidna oksidaza važna je i za metabolizam triptofana, a istovremeno i za biotransformaciju. Uglavnom se nalazi u citosolu stanica jetre, gušterače, pluća, koštanih mišića ili masnih stanica. Kofaktorni molibden vrlo je važan za aktivnost enzima. U ljudskoj DNK postoji samo jedan AOX gen koji može kodirati funkcionalni enzim. Nekoliko gena AOX je aktivno u drugih kralježnjaka. Aldehid oksidaza je vrlo slična enzima ksantin dehidrogenaza i povezana je s njim.
Oba enzima mogu pretvoriti hipoksantin u ksantin apsorbiranjem atoma kisika i molekule vode. Pretvorba ksantina u mokraćnu kiselinu, međutim, odvija se samo ksantin hidrogenazom (ksantin oksidaza). Aldehidna oksidaza sastoji se od 1338 aminokiselina. Molibdopterin, FAD i 2 (2Fe2S) služe kao kofaktori za njihovu učinkovitost. Reakcija koju već opisuje naziv karakterizira pretvorbu aldehida uz dodatak kisika i vode u karboksilne kiseline i vodikov peroksid.
Funkcija, efekt i zadaće
Enzim aldehid oksidaza katalizira nekoliko reakcija. Najvećim dijelom odgovoran je za pretvorbu aldehida u karboksilne kiseline uz dodatak kisika i vode. Aldehidna oksidaza općenito posreduje dodavanje atoma kisika supstratu.
Između ostalog, katalizira i pretvorbu nikotina u konin. Zbog toga također igra veliku ulogu u biotransformaciji i metabolizmu triptofana. U tim reakcijama molibden je uvijek potreban kao kofaktor. Kao dio biotransformacije, pretvara ksenobiotike s aldehidnim skupinama u odgovarajuće karboksilne kiseline u reakciji faze I. U reakciji faze II, glukuronska kiselina je spojena na karboksilne skupine kako bi povećala topljivost u vodi kako bi se strane molekule istjerale iz tijela.
Strukturno i kemijski aldehidna oksidaza usko je povezana s homolognim enzimom ksantin hidrogenazom (ksantin oksidaza). Međutim, nije poznato zašto pretvorbu ksantina u mokraćnu kiselinu uz dodatak kisika i vode katalizira samo ksantin oksidaza. Oba enzima još uvijek kataliziraju pretvorbu hipoksantina u ksantin. Nadalje, aldehidna oksidaza odgovorna je i za adipogenezu (reprodukciju masnih stanica).
Potiče izlučivanje tkivnog hormona adiponectin. Adiponektin, zauzvrat, povećava učinkovitost inzulina. U hepatocitima adiponektin zauzvrat inhibira oslobađanje aldehidne oksidaze. Manjak aldehid oksidaze (AOX1) također inhibira izvoz lipida iz stanica. Točna funkcija aldehidne oksidaze još nije u potpunosti razjašnjena.
Obrazovanje, pojava, svojstva i optimalne vrijednosti
Aldehid oksidaza nalazi se uglavnom u citoplazmi jetrenih stanica. Međutim, on se nalazi i u masnim stanicama, plućnom tkivu, skeletnim mišićima i gušterači. Nekada je bila miješana s homolognom ksantin oksidazom.
Oba enzima imaju sličnu strukturu. Međutim, ponekad kataliziraju različite reakcije. Oba enzima za svoju funkciju trebaju isti kofaktori. To su molibdopterin, FAD i 2 (2Fe2S). Međutim, aldehidna oksidaza ne samo da razgrađuje aldehide, već je odgovorna i za oksidaciju N-heterocikličkih spojeva, poput nikotina u kotinin.
Bolesti i poremećaji
Zajedno s ksantin dehidrogenazom (ksantin oksidaza) i sulfit oksidazom, aldehidna oksidaza ovisi o molibdenu kofaktora. Molibden je ugrađen u molibdopterin kao složen atom i tvori kofaktor molibdena. U slučaju nedostatka molibdena, ova tri enzima slabo funkcioniraju.
Ksantin dehidrogenaza katalizira razgradnju ksantina u mokraćnu kiselinu. Enzim aldehid oksidaza samo je djelomično uključen u ovaj postupak, na primjer kada se hipoksantin razgradi u ksantin. Ovdje se čak natječe i s ksantin oksidazom. Stoga ne postoji izolirani nedostatak aldehid oksidaze. Međutim, aldehidna oksidaza podržava razgradnju kateholamina. Sulfit oksidaza je odgovorna za razgradnju aminokiselina koje sadrže sumpor, poput cisteina, taurina ili metionina. Ako ovaj enzim ima nedostatak, sulfit se više ne pretvara u sulfat. Zbog molibdena kofaktora, tri enzima obično imaju zajednički nedostatak.
Naravno, izolirani nedostaci uslijed mutacija mogući su za svaki od ovih enzima. Međutim, do sada nije opisana klinička slika sa specifičnim nedostatkom aldehid oksidaze. Manjak molibdena izazvan neuravnoteženom prehranom vrlo je rijedak. Međutim, to se može dogoditi s parenteralnom prehranom koja ima molibden više od šest mjeseci. U takvim slučajevima tahipneja, tahikardija, jaka glavobolja, mučnina, povraćanje, središnja opstrukcija lica ili koma. Nadalje, postoje netolerancije na određene aminokiseline. Povišene koncentracije sulfita nalaze se u urinu, dok snižene vrijednosti mokraćne kiseline u krvi.
Ako nedostatak molibdena potraje, to može dovesti do problema s razgradnjom aminokiselina koje sadrže sumpor, alergija na sulfite, gubitak kose, niska razina mokraćne kiseline u krvi i problemi s plodnošću. Većina simptoma, međutim, nastaje zbog nedostatka sulfit oksidaze i ksantin dehidrogenaze. Tahikardija je vjerojatno posljedica povišene razine adrenalina ili noradrenalina (kateholamina), jer njihov raspad kasni s nedostatkom aldehidne oksidaze. Manjak molibdena može biti uzrokovan prehranom koja ima izuzetno nizak udio molibdena i upalnim bolestima crijeva poput Crohnove bolesti s malapsorpcijom hrane.
Nasljedni nedostatak kofaktora molibdena uslijed poremećaja sinteze molibdopterina je fatalan ako sva tri enzima ne uspiju.










.jpg)



.jpg)