hidroksilzina je neklasična proteinogena aminokiselina. Ugrađuje se u odgovarajući protein kao lizin i hidrolizira u hidroksilizin unutar polipeptida uz pomoć enzima. To je jedna od glavnih komponenti proteina kolagena u vezivnom tkivu.
Što je hidroksilizin?
Hidroksilizin je proteinogena aminokiselina koja se prvo uključuje u protein kao lizin. Stoga je nekanonska proteinogena aminokiselina. Izraz "kanonski" znači klasičan.
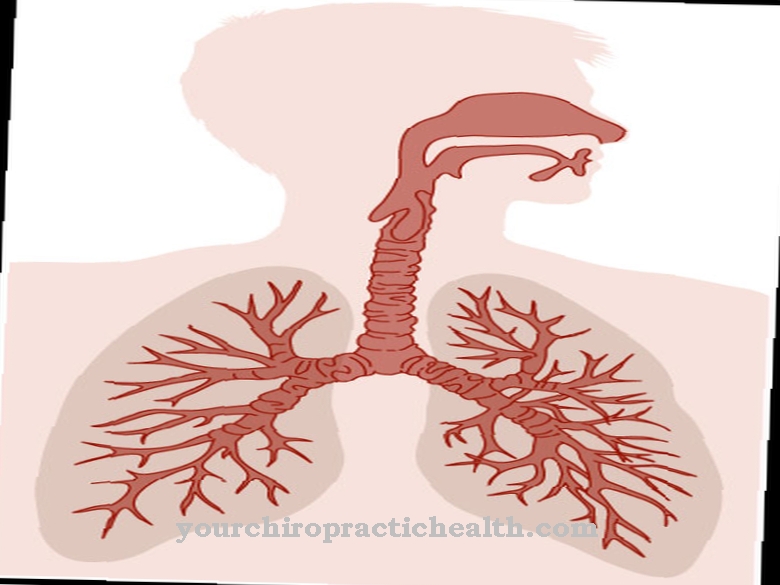
Dakle, kod ove aminokiseline nema kodona. Hidroksilizin se nalazi uglavnom u kolagenu vezivnog tkiva i u glikoproteinima. Tamo se lizin pretvara u hidroksilizin enzimatskim postupcima. Samo dio lizina pretvara se u hidroksilizin. Svojstva pojedinih kolagena ovise o količini hidroliziranih ostataka lizina i prolina.
Hidroksilizin se može izolirati u slobodnom obliku kao hidroklorid. Hidroklorid hidroksilizina je bež prah s talištem od 225 do 230 stupnjeva. To je bazična aminokiselina koja također čini da proteini koji sadrže hidroksilizin reagiraju bazično. Hidroksilizin je otkrio američki biokemičar i suosnivač "Kliničke kemije" Donald Van Slyke (1883-1971).
Funkcija, efekt i zadaće
Hidroksilizin je od velike važnosti za strukturu vezivnog tkiva. Glikoproteini također sadrže hidroksilizin da bi tvorili glikozidne spojeve proteina sa ostacima šećera na hidroksilnom ostatku.
Unutar kolagena odgovoran je za umrežavanje pojedinih molekula proteina. Zajedno s hidroksilprolinom, hidroliziranim oblikom prolina, također je od koristi za izgradnju tercijarnih i kvaternarnih struktura kolagena. Hidroksilacija lizina katalizira enzim lizil hidroksilaza uz sudjelovanje kofaktorskih iona željeza i askorbinske kiseline (vitamin C). Obrazac raspodjele hidroksiliranih ostataka lizina u kolagenu nije ni posebno kruti niti fleksibilan. Uvijek se ponavljaju obrasci.
Međutim, unutar proteina postoje i čitava područja koja ne sadrže hidroksilirane ostatke lizina. Dok je hidroksiprolin odgovoran za spiralnu strukturu kolagena vezanjem triju proteinskih lanaca, unakrsne veze između različitih molekula proteina nastaju preko hidroksilnih skupina hidroksilizina. Uz to, te molekularne skupine služe i kao vezivno mjesto za glikozidnu vezu sa šećerom. Ukupno gledajući, to osigurava čvrstoću vezivnog tkiva.
Ako postoji nedostatak hidroksilizina unutar proteina, to se ne može popraviti dodatnim unosom aminokiseline. Ne postoji kodon za slobodni hidroksilizin, tako da ne može biti ugrađen u odgovarajući protein. Vrijednost dodataka prehrani s dodatkom hidroksilizina stoga je vrlo upitna. Stoga, nedostatak mora biti posljedica nedovoljne hidroksilacije lizina.
Obrazovanje, pojava, svojstva i optimalne vrijednosti
Hidroksilizin se nalazi samo u ljudskom i životinjskom kolagenu. Postoje i neki glikoproteini koji također sadrže hidroksilizin. To uključuje adiponektin. Adiponektin je hormon koji se proizvodi u masnom tkivu i presudno utječe na učinkovitost inzulina. Hidroksilizin je također otkriven u nekim bakterijama, poput Staphylococcus aureus.
Raspodjela hidroksiliranog lizina nije ujednačena u kolagenu. Postoje mjesta na kojima se gotovo uvijek nalazi. U ostalim područjima hidroksilizin gotovo nikada nije pronađen. Ova neujednačena raspodjela određuje strukturu kolagena. Unutar strukture kolagena trostruke spirale, hidroksilizin je uvijek smješten na položaju Y ponavljajuće sekvence Gly-X-Y. U kratkim regijama s ne-spiralnom strukturom, hidroksilizin se pojavljuje i na drugim mjestima.
Bolesti i poremećaji
Vezivno tkivo apsolutno ovisi o prisutnosti hidroksilizina. Kolagen može biti stabilan i čvrst samo ako umrežene veze proteinskih molekula djeluju. Manjak hidroksilizina uzrokuje slabost vezivnog tkiva.
Ako je prisutan samo u izuzetno malim količinama ili ga uopće nema, odgovarajući organizam ne bi bio održiv. Vezno tkivo više nije moglo obavljati svoj zadatak kao ograničavajuće i potporno tkivo za organe. U stvari, postoje bolesti koje se mogu pratiti manjkom hidroksilizina. Budući da se ova aminokiselina u početku ugrađuje kao lizin tijekom sinteze proteina, to ne može biti primarni nedostatak. Hidroksilizin nastaje iz lizina unutar proteina kolagena uz pomoć lizil hidroksilaza. Manjak hidroksilizina može nastati samo iz oštećenja ovog enzima ili njegove nedovoljne funkcije.
Postoji skupina heterogenih kongenitalnih slabosti vezivnog tkiva koja je poznata kao Ehlers-Danlos sindrom. Za ovu kliničku sliku mogu odgovarati brojne mutacije. Između ostalog, lizil hidroksilaza može biti i oštećena, tako da je premalo lizina hidroksilirano. Ehlers-Danlos sindrom očituje se prekomjernom rastezljivošću kože i prekomjernošću zglobova. Također su pogođeni unutarnji organi, krvne žile, tetive, ligamenti i mišići. Prognoza ovisi o težini oštećenja. Ako su plovila uključena, očekuje se nepovoljan tijek. Potpuni neuspjeh enzima lizil hidroksilaza nije spojiv sa životom i stoga se ne primjećuje.
Ali čak i kod netaknutog enzima, zbog slabog djelovanja može postojati slabo vezivno tkivo. Lizil hidroksilaza zahtijeva kofaktore iona željeza i askorbinske kiseline (vitamin C). Ako, primjerice, nedostaje vitamin C, događa se ono što je poznato kao skorbut. Škrob je stečena bolest vezivnog tkiva uzrokovana nedostatkom hidroksilnih skupina na ostacima kolagena u prolini i lizinu. Uzrok je niska aktivnost prolin hidroksilaze i lizin hidroksilaze zbog nedostatka askorbinske kiseline.











.jpg)



.jpg)