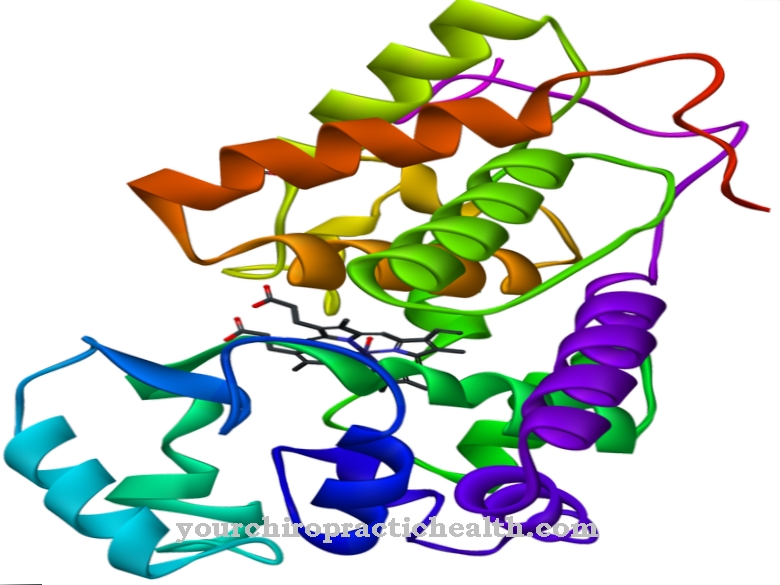
Enteropeptidase je enzim dvanaestopalačne sluznice čija je funkcija aktiviranje enzima gušterače. Ono stoji na početku cijele kaskade aktivacije probavnih enzima. Disfunkcija enteropeptidaze dovodi do nepravilnosti u probavi i malapsorpcije hrane u tankom crijevu.
Što je enteropeptidaza?
Enteropeptidaza je enzim dvanaestopalačne mukoze, koji aktivira probavne enzime gušterače aktiviranjem tripsinogena u tripsin.
Enteropeptidaza se izlučuje u granici četkice dvanaestopalačne sluznice. Naime, Liebekühnove žlijezde odgovorne su za izlučivanje. Liebekühnove žlijezde su cjevaste udubine u epitelu tankog i debelog crijeva. U tankom crijevu nalaze se između vilica tankog crijeva. Žlijezde, poznate i kao kriptovalute Lieberkühn, osim enteropeptidaze izlučuju i veliki broj enzima. Izlučivanje enteropeptidaze potiče se kada him, koji je prethodno probavljen u želucu, uđe u dvanaesnik. Sam enzim ne utječe na komponente hrane.
Samo aktiviranje enzima tripsin pokreće čitavu kaskadu aktivacije probavnih enzima u pokretu. Enteropeptidaza, poput tripsina i ostalih proteaza gušterače, je serinska proteaza. Aktivni centar sadrži katalitičku trijadu asparaginske kiseline, histidina i serina. Kao endopeptidaza, enteropeptidaza cijepi proteine samo u određenim karakterističnim točkama s određenim motivima prepoznavanja u slijedu aminokiselina. Enzim se uvijek cijepa na motivu prepoznavanja Asp-Asp-Asp-Asp-Lys. Pomoću tripsinogena cijepa se heksapeptid Val- (Asp) 4-Lys, pri čemu nastaje tripsin.
Funkcija, efekt i zadaće
Funkcija enteropeptidaze je aktiviranje probavnih enzima u gušterači. On samo pokreće prvi korak aktivacije pretvorbom tripsin-a u tripsin.
Trippsin je zauzvrat serinska proteaza koja cijepa proteine na temelju istog karakterističnog motiva prepoznavanja. Sada nastavlja aktivaciju samog tripsinogena. Istodobno, aktivira druge enzime gušterače iz odgovarajućih prekursora, poput kimotripsinogena, pro-elastaze, prokarboksipeptidaze, pro-fosfolipaze i proenteropeptidaze. Enteropeptidaza je također u početku u neaktivnoj proformi. Kada hrana uđe u dvanaesnik, pored proenteropeptidaze izlučuje se i duodenaza, koja aktivira proform enteropeptidaze. Nakon što započne kaskada aktivacije, tripsin preuzima aktivaciju svih enzima gušterače, uključujući proenteropeptidazu i tripsingen.
Aktivacija proenteropeptidaze na enteropeptidazu odvija se još učinkovitije djelovanjem tripsina nego kroz duodenazu. Primarna prisutnost probavnih enzima u njihovom neaktivnom obliku izuzetno je važna. Djelovanje posebno proteaza je nespecifično. Svi proteini koji sadrže karakteristični motiv prepoznavanja unutar molekule hidrolizirano su cijepani. Ako bi enzimi bili katalitički aktivni, tjelesni proteini već bi se probavljali u gušterači i gušterači. Kao rezultat toga, gušterača bi se otopila. Aktivacija se odvija samo u dvanaesniku izvan egzokrinih žlijezda.
Ovdje enzimi mogu započeti razgradnju komponenata hrane bez napada tjelesnih vlastitih tkiva. Kako bi se spriječilo aktiviranje enzima prijevremeno, dodatni inhibitor tripsina djeluje u kanalu gušterače. Ključnu ulogu, međutim, probavna kaskada igra tripsin. Jednom kada se ovaj enzim aktivira, aktiviranje svih probavnih enzima, uključujući enteropeptidazu, ne može se zaustaviti.
Obrazovanje, pojava, svojstva i optimalne vrijednosti
Kao i sve serinske proteaze, i enteropeptidaza ima nespecifični učinak i cijepa proteine koristeći karakteristični motiv prepoznavanja. Enteropeptidaza se sastoji od lakog i teškog lanca koji su povezani disulfidnim mostovima. Domena serinske proteaze nalazi se na lakom lancu.
Teški lanac ima molekulsku masu od 82 do 140 kilodaltona, a molekulska masa lakog lanca je 35 do 62 kilodaltona. Struktura lakog lanca enteropeptidaze slična je ostalim serin proteazama tripsin i kimotripsin. Teški lanac je vezan na membranu i utječe na specifičnost enzima. Utvrđeno je da izolirani laki lanac ima sličan učinak u odnosu na karakteristični motiv raspoznavanja - (Asp) 4-Lys-, ali značajno niži učinak protiv tripsinogena.
Bolesti i poremećaji
Ljudska enteropeptidaza kodira ENTK gen na kromosomu 21. Mutacija ovog gena može dovesti do ozbiljnih bolesti u oboljele djece.
Enzim više ne može aktivirati ostale probavne enzime. Komponente hrane se više ne razgrađuju i stoga ih tanko crijevo više ne može apsorbirati. Prvenstveno se radi o zloćudnosti (nedovoljnom razgradnji), što dovodi do malapsorpcije komponenata hrane. Tijelo više nije adekvatno opskrbljeno hranjivim tvarima. Ne uspijevaju napredovati, usporava rast i tipični simptomi nedostatka proteina s razvojem edema. Istovremeno, osim bjelančevina, ugljikohidrati i masti slabo se apsorbiraju. Budući da ne probavljene namirnice hrane dopiru do debelog crijeva i tamo se razgrađuju fermentacijom i trulim bakterijama, javljaju se nadutost, proljev i bolovi u trbuhu.
Do sada je u svijetu opisano 15 slučajeva urođenog nedostatka enteropeptidaze. Međutim, simptomi stanja su mnogo češći. Manjak enteropeptidaze ne mora uvijek biti prisutan. Budući da tripsin igra ključnu ulogu u aktiviranju probavnih enzima, nedostatak ili nedostatak tripsina također dovode do sličnih simptoma. Liječenje ovih bolesti je u oba slučaja isto. Enzimi se primjenjuju u aktiviranom obliku. Sigurno je mnogo više nedijagnosticiranih slučajeva nedostatka enteropeptidaze.
Ako je dijagnoza sigurna, enteropeptidaza bi također mogla biti zamijenjena. Manjak enteropeptidaze također je potaknut sekundarnim teškim crijevnim bolestima.Bolesti poput celijakije, skraćenog tankog crijeva, nedostatak laktaze ili drugih treba razjasniti u diferencijalnoj dijagnozi.


.jpg)










.jpg)



.jpg)