citidin pripada nukleozidima, a sastoji se od nukleinske baze citozina i šećerne riboze. Tvori bazni par s gvanozinom preko vodikovih veza. On također igra središnju ulogu u metabolizmu pirimidina.
Što je citidin?
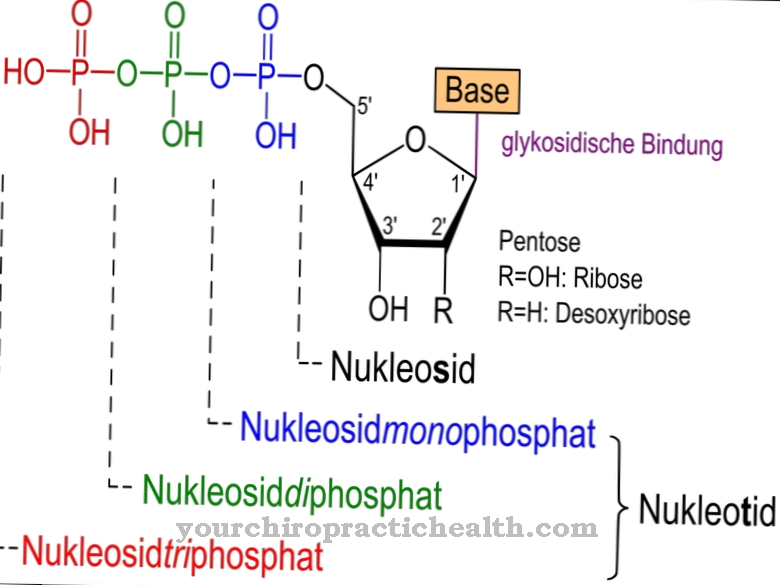
Citidin je nukleozid koji se sastoji od citozina i riboze. Osim adenina, gvanina i timina, citozin dušične baze uključen je u sintezu nukleinskih kiselina. Fosforilacija citidina stvara citidin monofosfat (CMP), citidin difosfat (CDP) ili citidin trifosfat (CTP).
Citidin monofosfat je nukleotid u RNA. Dvije purinske i dvije pirimidinske baze uključene su u strukturu nukleinskih kiselina, pri čemu se timin zamijeni za uracil u RNA. Adenin i gvanin pripadaju purinskim bazama, dok timin, citozin i uracil pripadaju pirimidinskim bazama. Citidin deaminaza može deaminirati citidin u uridin. Uridin je nukleozid stvoren od riboze i uracila. Može se fosforilirati i uridin-monofosfat.
Uridin monofosfat je također važan nukleotid za RNA. Nadalje, CDP i CTP također su aktivirajuće skupine za sintezu lecitina, cefalina i kardiolipina. Čisti citidin prisutan je u vodi topivoj krutini koja se raspada na 201 do 220 stupnjeva. Može se katalitički razgraditi na citozin i ribozu pomoću enzima pirimidin nukleozidaza.
Funkcija, efekt i zadaće
Citidin ima središnju ulogu u metabolizmu pirimidina. Pirimidin pruža osnovnu strukturu za pirimidinske baze citozin, timin i uracil koji se pojavljuju u nukleinskim kiselinama. Timin u RNK zamijenjen je za uracil.
Uracil se također proizvodi deaminacijom citidina citidin deaminazom. Kemijske pretvorbe između tri baze pirimidina su od središnjeg značaja za procese popravljanja DNK i epigenetske promjene. U kontekstu epigenetike, razna svojstva su modificirana utjecajima okoline. Međutim, genetski se materijal ne mijenja. Modifikacijske promjene organizma uzrokovane su različitim izrazom gena. Procesi diferencijacije tjelesnih stanica za stvaranje različitih staničnih linija i organa također predstavljaju epigenetski proces, ovisno o staničnoj vrsti, različiti geni se aktiviraju ili deaktiviraju.
To se događa metilacijom citidinskih baza unutar DNK. Tijekom metilacije nastaje metilcitozin koji se deaminacijom može pretvoriti u timin. Komplementarna nukleobaza gvanin u suprotnom dvostrukom lancu omogućava prepoznavanje pogreške i ponovno zamjenu timina za citozin. Međutim, gvanin se može zamijeniti i za adenin što dovodi do točkaste mutacije. Ako se nemetilirani citozin deaminira, stvara se uracil. Budući da se uracil ne pojavljuje u DNK, odmah ga zamjenjuje citozinom. Umjesto citozina, stopa mutacije uslijed metilacije lagano je povećana.
Istovremeno, međutim, sve se više gena isključuje metilacijom što rezultira daljnjom specijalizacijom stanica unutar stanične linije. U postupcima popravljanja, popravljajući enzimi temelje se na izvornom lancu DNA, koji prepoznaju kroz viši stupanj metilacije. Komplementarni niz također se gradi na temelju tamo pohranjenih podataka. Pogreške instalacije ispravljaju se odmah. Nadalje, enzim AID (aktivacija inducirana Cytidine Deaminase) vrlo specifično katalizira deaminaciju citidinskih skupina uridinske skupine u jednolančanoj DNK. Pojavljuju se somatske hipermutacije, koje mijenjaju antitijela niz B stanica. Tada se biraju odgovarajuće B stanice. To omogućava fleksibilan imunološki odgovor.
Obrazovanje, pojava, svojstva i optimalne vrijednosti
Citidin je intermedijarni produkt metabolizma pirimidina. Kao izolirana veza, nije važno. Kao što je već spomenuto, sastavljena je od nukleinske baze citozina i riboze šećerne kiseline u četvrtini. Tijelo može sam sintetizirati citozin.
Međutim, njegova sinteza je vrlo energetski intenzivna, tako da se oporavlja od građevnih blokova nukleinske kiseline u okviru puta spašavanja i može se ponovno integrirati u nukleinske kiseline. Kada se baza potpuno razgradi, nastaju ugljični dioksid, voda i urea. Prisutna je kao nukleozid u RNA. U DNA se citozin veže na deoksiribozu, tako da se nukleozidni deoksicitidin ovdje pojavljuje kao građevni blok.
Bolesti i poremećaji
Metilacije na citidinskim ostacima DNK vrlo su važne za obilježavanje radi odvajanja različitih biokemijskih procesa. Međutim, pogreške se mogu pojaviti i kod metilacije koja dovodi do bolesti.
U slučaju oštećenja metilacije može se pokrenuti povećana i smanjena aktivnost gena koje ne udovoljavaju uvjetima. Ovi uzorci metilacije prenose se tijekom diobe stanica. Dugoročno se događaju promjene koje mogu dovesti do bolesti. Na primjer, neke stanice tumora imaju različite strukture metilacije koje se ne javljaju u zdravim stanicama. Na primjer, metilacija može blokirati određene gene koji kodiraju enzime koji reguliraju rast. Ako ti enzimi nedostaju, može doći do neinhibiranog rasta stanica. Ovo se također odnosi na enzime koji iniciraju urednu staničnu smrt (apoptozu) kada dođe do oštećenja stanica.
Ciljano utjecaj metilacije DNA još nije moguće. Međutim, postoje studije o potpunoj demetilaciji tumorskih stanica kako bi ih se opet podvrglo kontroli proteina koji reguliraju rast. Prema nekoliko kliničkih studija, pokazano je da demetilacija ograničava rast tumora u bolesnika s akutnom mijeloidnom leukemijom. Ovaj postupak je poznat i kao epigenetska terapija. Postupci metilacije također mogu igrati ulogu u drugim bolestima. Zbog utjecaja okoline, organizam se prilagođava promijenjenim uvjetima stvaranjem bioloških modifikacija koje se temelje na metilaciji citidinskih ostataka DNK. Tijelo na taj način provodi proces učenja, koji može, međutim, uzrokovati i pogrešno reguliranje.

.jpg)






.jpg)



.jpg)