Lizil oksidaza je enzim vezivnog tkiva koji ima katalitičke zadatke i potiče umrežavanje kolagena i elastina. Enzim ima stabilizirajući učinak na vezivno tkivo provodeći oksidacijsku deaminaciju i tako stvara osnovne uvjete za umrežavanje. U Cutis laxa aktivnost liziksoksidaze je smanjena.
Što je lizil oksidaza?
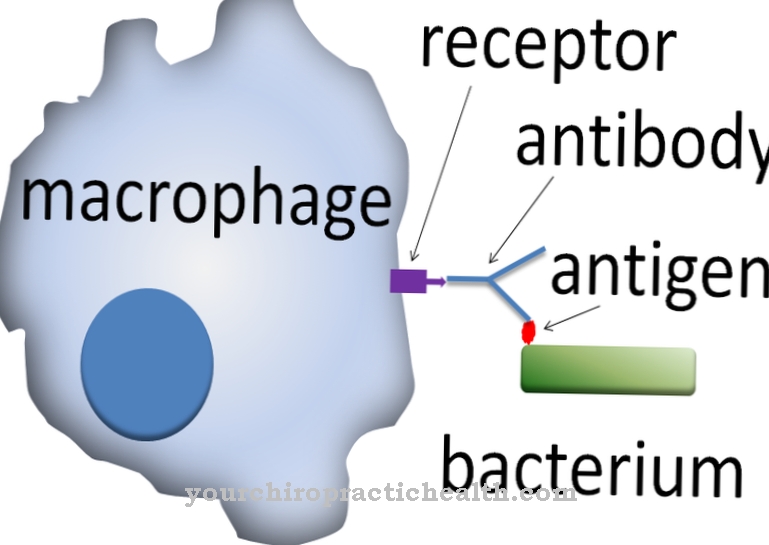
U ljudskom tijelu postoje različiti enzimi koji svi imaju katalitičku aktivnost. Enzimi omogućuju reakcije u ljudskom tijelu ili ih ubrzavaju. Lizil oksidaza je enzim koji se nalazi u ljudskom vezivnom tkivu. Naziva se i proteinskom lizinom 6 oksidazom, a nalazi se uglavnom u vanćelijskom prostoru vezivnog tkiva.
Katalitička aktivnost enzima u ovom se slučaju odnosi na umrežavanje kolagena i elastina. Liziksoksidaza mehanički stabilizira dva proteina i na taj način omogućava reaktivnu vezu. Liziksoksidaza se ne nalazi samo u ljudskom tijelu. Ostali kralježnjaci također su opremljeni enzimom. Smatra se da je liziksoksidaza stabilizator vezivnog tkiva. Manjak enzima dovodi do kliničke slike cutis laxa, teške i nasljedne slabosti vezivnog tkiva.
Funkcija, efekt i zadaće
Lizil oksidaza preuzima važne zadatke u izvanćelijskom prostoru u unakrsnoj vezi između pojedinih molekula kolagena. U ljudskom tijelu kolagen igra glavnu ulogu unutar proteina, s oko 30 posto ukupne proteinske mase.
Kolagen je najčešći protein. Strukturni je i građevinski protein koji čini mnoge dijelove tijela, poput vezivnog tkiva, kostiju, zuba, hrskavice, tetiva, ligamenata i kože. Lizil oksidaza podržava vezanje kolagena na karbonilnim skupinama i na taj način doprinosi stabilnosti navedenih tjelesnih komponenti. Ima katalitičku aktivnost za proizvodnju karbonilnih skupina koje formiraju kovalentne poprečne veze na kolagenima u aldolskoj kondenzaciji. Katalitička zadaća liziksoksidaze je stoga priprema za stvaranje vlakana. Enzim stvara sve kemijske uvjete potrebne za formiranje.
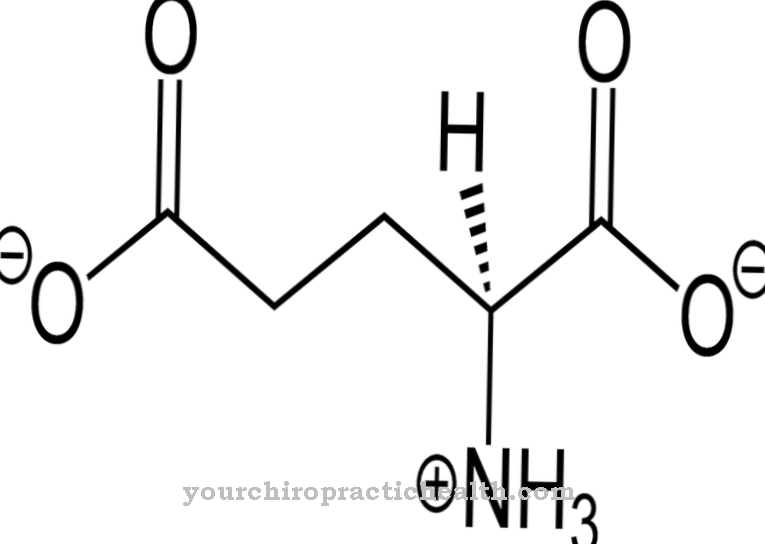
Vlakna se smatraju vlaknima vlakana. Odgovaraju tankim i vlaknastim dijelovima tijela, a nalaze se u biljnim stijenkama stanica, u ljudskim mišićima i u vezivnom tkivu. Zadaća lizil oksidaze u ovom je kontekstu u osnovi oksidacijsko deaminiranje lizilnih ostataka. U kemiji deaminacija je kemijsko cijepanje amino skupina kao amonijevi ioni ili amonijak. Oksidativna deaminacija razdvaja aminokiseline L-glutamata aminokiseline iz vodika i oksidira ih do imino skupina s prijenosom vodika u NAD + ili NADP +.
Nakon toga slijedi hidrolizno cijepanje imino skupina kao amonijevih iona, što je povezano s stvaranjem α-keto kiseline. Deaminacija odgovara prvom koraku biokemijskog raspada aminokiselina, koji se kod sisavaca uglavnom odvija u jetri. Amonijev ion nastao deaminacijom pretvara se u ureu. Procesi deaminacije lizil oksidaze stvaraju aldehidne skupine koje s pojedinim amino skupinama drugih lizilnih ostataka stvaraju takozvane Schiffove baze i na taj način mogu formirati stabilizirajuće križne veze u kolagenu.
Obrazovanje, pojava, svojstva i optimalne vrijednosti
Lizil-oksidazu u DNK kodira LOX gen koji se kod ljudi nalazi na kromosomu 5 u lokusu gena q23.3 do q31.2. Genski produkt nije konačni oblik enzima. Proizvod nije gotova liziloksidaza, već oblik prethodnika koji, nakon prevođenja, ima molarnu masu od 47 kDa.
U daljnjem toku nastaje glikozilacija. Tijekom ovog postupka, molarna masa kasnijeg enzima povećava se na 50 kDa, a prethodni oblik lizil oksidaze izlučuje se u izvanćelijski prostor. Nakon izlučivanja, pre-pro-lizil-oksidaza obrađuje se dalje. Tvar se dijeli u izvanćelijskom prostoru. Protein 1 odgovoran je za cijepanje na dva fragmenta i na taj se način s jedne strane stvara 32 kDa lizil oksidaza. S druge strane, stvara se rezidualna tvar koja u ovom slučaju odgovara polipeptidu.
Bolesti i poremećaji
Genetske oštećenja liziksoksidaze mogu uzrokovati kliničku sliku cutix laxa. Ova se bolest naziva i dermatokaliza i odnosi se na skupinu često povezanih dobnih slabosti vezivnog tkiva, koje se u većini slučajeva opažaju obiteljskim nakupljanjem.
Zajednička karakteristika svih pojava dermatokalaze je opuštena i neelastična koža koja se često spušta u velikim naborima na raznim dijelovima tijela. Većina promjena pogođenih izgleda starije nego što su bili zbog promjena. Bolesti su, između ostalog, uzrokovane genetskim mutacijama. U tom kontekstu govorimo o cutis laxa sindromu. Bolest može postojati u autosomno recesivnim, autosomno dominantnim i x-kromsomskim oblicima. U mnogim slučajevima sindrom cutis laxa povezan je s drugim anomalijama i, primjerice, ako su organi uključeni, može biti fatalan.
ARCL1 odgovara cutis laxu autosomno recesivnog tipa 1 i smatra se najtežim oblikom koji pod određenim okolnostima može dovesti do životnih komplikacija. Oblik ARCL1A povezan je s mutacijama u genu FBLN5 na mjestu 14q32.12. Tip ARCL1B povezan je s mutacijama u genu EFEMP2 na lokusu 11q13.1, a varijanta ARCL1C odgovara cutis laxa s pratećim anomalijama u plućima, gastrointestinalnim i mokraćnim putovima, koje nastaju zbog mutacija gena LTBP4 u lokusu 19q13.2.
Mutacije u spomenutim genima dovode do ispodprosječne aktivnosti liksiloksidaze. Neadekvatne unakrsne veze nastaju zbog smanjene aktivnosti enzima. Pacijentovo vezivno tkivo nije dovoljno stabilizirano.



.jpg)



.jpg)